All In Journal Student
Sword Art Online : The Animation
Sebuah anime jepang yang diangkat dari novel kemudian diangkat menjadi game console PSP, anime ini dirilis pada tanggal Jun 4, 2012. Anime bercerita tentang seorang anak muda yang bernama Kazuto Kirigaya seorang gamer online yang baru saja membeli game MMORPG terbaru, yang hanya dirilis sebanyak 10.000 copy saja. Game ini berjudul "Sword Art Online" hasil karya seorang programmer jenius bernama Kayaba Akihiko game virtual yang memungkinkan player merasakan situasi langsung sedangkan tubuh asli si player tertidur. Kazuto yang merupakan salah satu dari beberapa beta tester atau player yang memainkan game yang masih dalam tahap uji coba sebelum dirilis di publik ini tidak menghadapi kesulitan saat bermain gamenya. Kemudian pada saat hari pertama memainkan game seluruh pemain tidak dapat log out dari game sehingga mereka tidak dapat kembali ke dunia nyata, dan sang programmer memberitakan bahwa untuk log out dari game tersebut harus menamatkan game yang terdiri dari 100 lantai, apakah para gamer dan Kirito dapat selamat dari game kematian tersebut ? Anime ini dapat di download di cyber12.com".
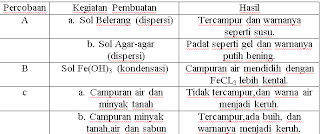
Laporan Praktikum Pembuatan Koloid
Sifat pengahamburan cahaya oleh koloid di temukan oleh John Tyndall, oleh karena itu sifat ini dinamakan Tyndall. Efek dari Tyndall digunakan untuk membedakan system koloid dari larutan sejati,
Dibawah mikroskop ultra, partikel koloid akan tampak sebagai titik cahaya. Jika pergerakan titik cahaya atau partikel tersebut diikuti, partikel itu bergerak terus-menerus dengan gerakan zigzag. Hal ini pertama kali diamati oleh Robert Brown (1773-1858), seorang ahli botani inggris pada tahun 1827. Ia sedang mengamati butiran sari tumbuhan pada permukaan air dean mikroskop. Partikel koloid dalam medium pendispersinya disebut gerak brown.
Partikel sol padat ditempatkan dalam zat cair atau gas, maka partikel zat cair atau gas akan terakumulasi. Fenomena disebut adsorpsi. Jadi sdsorpsi terkait dengan penyerapan partikel pada permukaan zat. Partikel koloid sol memiliki kemampuan untuk mengadsorpsi partikel pendispersi pada permukaanya. Daya adsorpsi partikel koloid tergolong besar Karenna partikelnya memberikan sesuatu permukaan yang luas. Sifat ini telah digunakan dalam berbagai proses seperti penjernihan air.
Sifat koloid terpenting adalah muatan partikel koloid. Semua partikel koloid memiliki muatan sejenis (positif dan negatif). Maka terdapat gaya tolak menolak antar partikel koloid. Partikel koloid tidak dapat bergabung sehingga memberikan kestabilan pada sistem koloid. Sistem koloid secara keseluruhan bersifat netral.
Partikel-partikel koloid yang bersifat stabil karena memiliki muatan listrik sejenis. Apabila muatan listrik itu hilang , maka partikel koloid tersebut akan bergabung membentuk gumpalan. Proses penggumpalan partikel koloid dan pengendapannya disebut Koagulasi.
Sistem koloid dimana partikel terdisperesinya mempunyai daya adsorpsi yang relatif besar disebut koloid liofil.
PRAKTIK HIDROLISIS GARAM
Teori : Pengertian Hidrolisis Garam
Pencampuran larutan asam dengan larutan basa akan menghasilkan garam dan air. Namun demikian, garam dapat bersifat asam, basa maupun netral. Sifat garam bergantung pada jenis komponen asam dan basanya. Garam dapat terbentuk dari asam kuat dengan basa kuat, asam lemah dengan basa kuat, asam kuat dengan basa lemah, atau asam lemah dengan basa lemah. Jadi, sifatasam basa suatu garam dapat ditentukan kekuatan asam dan basa penyusunnya. Sifat keasaman atau kebasaan garam ini disebabkan oleh sebagian garam yang larut beraksi dengan air. Proses larutnya sebagian garam beraksi dengan air ini disebut hidrolisis ( hidro yang berarti air dan lisis yang berarti peruraian ).
Ada Empat Jenis Garam, Yaitu;
1. Garam dari Asam Kuat dengan Basa Kuat.
Asam kuat dan basa kuat bereaksi membentuk garam dan air. Kation dan anion garam berasal dari elektrolit kuat yang tidak terhidrolisi, sehingga larutan ini bersifat netral, Ph =7.
Contoh :
Larutan KCl berasal dari basa kuat KOH terionisasi sempurna membentuk kation dan anionnya. KOH terionisasi menjadi H+ dan Cl- . Maing-masing ion tidak beraksi dengan air, reaksinya dapat ditulis sebagai berikut :
![]()
![]() KCl (aq) K+ (aq) + Cl- (aq)
KCl (aq) K+ (aq) + Cl- (aq)
![]() K+ (aq) + H2O(l)
K+ (aq) + H2O(l)
![]() Cl- (aq) + H2O (l)
Cl- (aq) + H2O (l)
2. Garam dari Asam Kuat dengan Basa Lemah.
Garam yang terbentuk dari asam kuat dengan basa lemah mengalami hidrolisis sebagian (parsial) dalam air. Garam ini mengandung kation asam yang mengalami hidrolisis. Larutan garam ini bersifat asam, pH <7.
NH 4 Cl (aq) → NH 4 + (aq) + Cl - (aq)
Cl - (aq) + H 2 O (l) →
NH 4 + (aq) + H 2 O (l) → NH 3(aq) + H 3 O + (aq)
Reaksi hidrolisis dari amonium (NH 4 + ) merupakan reaksi kesetimbangan. Reaksi ini menghasilkan ion oksonium (H 3 O + ) yang bersifat asam (pH<7). Secara umum reaksi ditulis:
BH + + H 2 O → B + H 3 O +
3. Garam dari Asam Lemah dengan Basa Kuat
Garam yang terbentuk dari asam lemah dengan basa kuat mengalami hidrolisis parsial dalam air. Garam ini mengandung anion basa yang mengalami hidrolisis. Larutan garam ini bersifat basa (pH > 7).
Contoh :
Natrium asetat (CH 3 COONa) terbentuk dari asam lemah CH 3 COOH dan basa kuat NaOH. CH 3 COOH akan terionisasi sebagian membentuk CH 3 COO - dan Na + . Anion CH 3 COO - berasal dari asam lemah yang dapat terhidrolisis, sedangkan kation Na + berasal dari basa kuat yang tidak dapat terhidrolisis.
Reaksi hidrolisis asetat (CH 3 COO ‑ )merupakan reaksi kesetimbangannya. Reaksi ini menghasilkan ion OH ‑ yang bersifat basa (pH > 7). Secara umum reaksinya ditulis:
A - + H 2 O → HA + OH –
4. Garam dari Asam Lemah dengan Basa Lemah
Asam lemah dengan basa lemah dapat membentuk garam yang terhidrolisis total (sempurna) dalam air. Baik kation maupun anion dapat terhidrolisis dalam air. Larutan garam ini dapat bersifat asam, basa, maupun netral. Hal ini bergantung dari perbandingan kekuatan kation terhadap anion dalam reaksi dengan air.
Contoh
Suatu asam lemah HCN dicampur dengan basa lemah, NH 3 akan terbentuk garam NH 4 CN. HCN terionisasi sebagian dalam air membentuk H + dan CN - sedangkan NH 3 dalam air terionisasi sebagian membentuk NH4+ dan OH-. Anion basa CN - dan kation asam NH4 + dapat terhidrolisis di dalam air.
NH 4 CN (aq) → NH 4 + (aq) + CN - (aq)
NH 4 + (aq) + H 2 O → NH 3(aq) + H 3 O (aq) +
CN - (aq) + H 2 O (e) → HCN (aq) + OH - (aq)
Sedikit Catatan:
Sifat larutan bergantung pada kekuatan relatif asam dan basa penyusunnya (Ka dan Kb)
- Jika Ka < Kb (asam lebih lemah dari pada basa) maka anion akan terhidrolisis lebih banyak dan larutan bersifat basa.
- Jika Ka > Kb (asam lebih kuat dari pada basa) maka kation akan terhidrolisis lebih banyak dalam larutan bersifat asam.
- Jika Ka = Kb (asam sama lemahnya dengan basa) maka larutan bersifat netral.
Alat dan Bahan :

Cara Kerja :
2.Setiap larutan diteteskan dalam lempeng tetes sekitar 10 tetes
3. Larutan diperiksa dengan mencelupan kertas saring merah dan biru
4. Perubahan warna yang terjadi diamati pada kertas lakmus.
Hasil Pengamatan :

Pertanyaan :
Jawab :

2. Tuliskan reaksi garam yang mengalami hidrolisis !
Jawab :

Kesimpulan :
Untuk mengetahui sifat ( asam, basa, netral ) larutan pada garam yang terhidrolisis harus mengetahui komponen penyusun garam itu sendiri.
ya itu tadi laporan praktikum kami, semoga bermanfaat
PRAKTIK LARUTAN BUFFER
LARUTAN BUFFER
Tujuan : Mempelajari perbedaan antara perubahan pH larutan buffer dan bukan larutan buffer karena penambahan sedikit asam,basa atau penyangga.
Teori : Pengertian larutan penyangga :
Larutan penyangga atau buffer adalah larutan yang digunakan untuk mempertahankan nilai pH tertentu agar tidak banyak berubah selama reaksi kimia berlangsung. Sifat yang khas dari larutan penyangga ini adalah pH-nya hanya berubah sedikit dengan pemberian sedikit asam kuat atau basa kuat.
Larutan penyangga tersusun dari asam lemah dengan basa konjugatnya atau oleh basa lemah dengan asam konjugatnya. Reaksi di antara kedua komponen penyusun ini disebut sebagai reaksi asam-basa konjugasi.
Komponen larutan penyangga terbagi menjadi :
§ Larutan penyangga yang bersifat asam
Larutan ini mempertahankan pH pada daerah asam (pH < 7). Untuk mendapatkan larutan ini dapat dibuat dari asam lemah dan garamnya yang merupak
an basa konjugasi dari asamnya. Adapun cara lainnya yaitu mencampurkan suatu asam lemah dengan suatu basa kuat dimana asam lemahnya dicampurkan dalam jumlah berlebih. Campuran akan menghasilkan garam yang mengandung basa konjugasi dari asam lemah yang bersangkutan. Pada umumnya basa kuat yang digunakan seperti natrium, kalium, barium, kalsium, dan lain-lain.
§ Larutan penyangga yang bersifat basa
Larutan ini mempertahankan pH pada daerah basa (pH > 7). Untuk mendapatkan larutan ini dapat dibuat dari basa lemah dan garam, yang garamnya berasal dari asam kuat. Adapun cara lainnya yaitu dengan mencampurkan suatu basa lemah dengan suatu asam kuat dimana basa lemahnya dicampurkan berlebih.
Perhitungan pH larutan penyangga :
§ Larutan penyangga asam Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
§ [H+] = Ka x a/valxg
§ atau
§ pH = p Ka - log a/g
dengan, Ka = tetapan ionisasi asam lemah
a = jumlah mol asam lemah
g = jumlah mol basa konjugasi
§ Larutan penyangga basa
Dapat digunakan tetapan ionisasi dalam menentukan konsentrasi ion H+ dalam suatu larutan dengan rumus berikut:
§ [OH-] = Kb x b/v
alxg
§ atau
§ pH = p Kb - log b/g
dengan, Kb = tetapan ionisasi basa lemah
b = jumlah mol basa lemah
g = jumlah mol asam konjugasi
Alat dan Bahan :

Cara Kerja :
1. 15 ml larutan CH3COOH 0,1 M dicampurkan dengan15 ml larutan CH3COONa 0,1 M. Kemudian ukurlah pH campuran itu dengan menggunakan indicator universal.
2. Campuran pada cara kerja 1 dibagi ke dalam 3 gelas kimia masing-masing 10 ml. Berilah nomor 1, 2, dan 3 pada gelas kimia tersebut.
3. 1 ml, 5 ml, dan 10 ml larutan HCl 0,1 M ditambahkan ke dalam gelas kimia 1 dengan menggunakan pipet. Aduk larutan dan ukur pH larutan pada setiap penambahan.
4. 1 ml, 5 ml, dan 10 ml larutan NaOH 0,1 M ditambahkan ke dalam gelas kimia 2. Ukurlah pH larutan pada setiap penambahan.
5. 10 ml aquadest ditambahkan ke dalam gelas kimia 3. Ukur pH larutan pada setiap penambahan.
6. Ulangi langkah 1-5, namun larutan penyangga diganti dengan NaCl 0,1M.
Hasil Pengamatan :

Pertanyaan :
1. Bagaimanakah pengaruh penambahan asam, basa dan pengenceran terhadap besar pH pada masing-masing larutan ?
Jawab : Pada saat larutan penyangganya CH3COOH + CH3COONa larutan tersebut dapat mempertahankan pHnya tetapi saat NaCl karena larutan garam jadi tidak dapat mempertahankan pH.
2. Larutan manakah yang bersifat buffer/penyangga ?
Jawab : CH3COOH + CH3COONa
3. Mengapa larutan buffer dapat mempertahankan pH ?
Jawab : Karena mengandung campuran asam lemah dengan garamnya atau basa lemah dengan garamnya.
Kesimpulan :
Jadi, kesimpulan dari percobaan yang kami lakukan adalah larutan CH3COOH + CH3COONa merupakan larutan yang bersifat buffer, dan larutan yang bersifat buffer itu dapat mempertahankan pH karena mengandung campuran asam lemah dengan garamnya atau basa lemah dengan garamnya, tetapi jika NaCl karena larutan garam jadi tidak dapat mempertahankan pH.