PEMBUATAN KOLOID
Tujuan : Membedakan serta memahami pembuatan
koloid secara disperse dan kondensasi.
Teori : Pengertian
koloid
Koloid adalah suatu campuran zat heterogen
antara dua zat atau lebih di mana partikel-partikel zat yang berukuran koloid
tersebar merata dalam zat lain. Ukuran koloid berkisar antara 1-100 nm ( 10-7 –
10-5 cm ).
Sifat-sifat Koloid :
a.
Efek
Tyndall
Sifat pengahamburan cahaya oleh koloid di temukan oleh John Tyndall, oleh karena itu sifat ini dinamakan Tyndall. Efek dari Tyndall digunakan untuk membedakan system koloid dari larutan sejati,
Sifat pengahamburan cahaya oleh koloid di temukan oleh John Tyndall, oleh karena itu sifat ini dinamakan Tyndall. Efek dari Tyndall digunakan untuk membedakan system koloid dari larutan sejati,
b. Gerak Brown
Dibawah mikroskop ultra, partikel koloid akan tampak sebagai titik cahaya. Jika pergerakan titik cahaya atau partikel tersebut diikuti, partikel itu bergerak terus-menerus dengan gerakan zigzag. Hal ini pertama kali diamati oleh Robert Brown (1773-1858), seorang ahli botani inggris pada tahun 1827. Ia sedang mengamati butiran sari tumbuhan pada permukaan air dean mikroskop. Partikel koloid dalam medium pendispersinya disebut gerak brown.
Dibawah mikroskop ultra, partikel koloid akan tampak sebagai titik cahaya. Jika pergerakan titik cahaya atau partikel tersebut diikuti, partikel itu bergerak terus-menerus dengan gerakan zigzag. Hal ini pertama kali diamati oleh Robert Brown (1773-1858), seorang ahli botani inggris pada tahun 1827. Ia sedang mengamati butiran sari tumbuhan pada permukaan air dean mikroskop. Partikel koloid dalam medium pendispersinya disebut gerak brown.
c. Adsorpsi koloid
Partikel sol padat ditempatkan dalam zat cair atau gas, maka partikel zat cair atau gas akan terakumulasi. Fenomena disebut adsorpsi. Jadi sdsorpsi terkait dengan penyerapan partikel pada permukaan zat. Partikel koloid sol memiliki kemampuan untuk mengadsorpsi partikel pendispersi pada permukaanya. Daya adsorpsi partikel koloid tergolong besar Karenna partikelnya memberikan sesuatu permukaan yang luas. Sifat ini telah digunakan dalam berbagai proses seperti penjernihan air.
Partikel sol padat ditempatkan dalam zat cair atau gas, maka partikel zat cair atau gas akan terakumulasi. Fenomena disebut adsorpsi. Jadi sdsorpsi terkait dengan penyerapan partikel pada permukaan zat. Partikel koloid sol memiliki kemampuan untuk mengadsorpsi partikel pendispersi pada permukaanya. Daya adsorpsi partikel koloid tergolong besar Karenna partikelnya memberikan sesuatu permukaan yang luas. Sifat ini telah digunakan dalam berbagai proses seperti penjernihan air.
d. Muatan koloid
Sifat koloid terpenting adalah muatan partikel koloid. Semua partikel koloid memiliki muatan sejenis (positif dan negatif). Maka terdapat gaya tolak menolak antar partikel koloid. Partikel koloid tidak dapat bergabung sehingga memberikan kestabilan pada sistem koloid. Sistem koloid secara keseluruhan bersifat netral.
Sifat koloid terpenting adalah muatan partikel koloid. Semua partikel koloid memiliki muatan sejenis (positif dan negatif). Maka terdapat gaya tolak menolak antar partikel koloid. Partikel koloid tidak dapat bergabung sehingga memberikan kestabilan pada sistem koloid. Sistem koloid secara keseluruhan bersifat netral.
e. Koagulasi
Partikel-partikel koloid yang bersifat stabil karena memiliki muatan listrik sejenis. Apabila muatan listrik itu hilang , maka partikel koloid tersebut akan bergabung membentuk gumpalan. Proses penggumpalan partikel koloid dan pengendapannya disebut Koagulasi.
Partikel-partikel koloid yang bersifat stabil karena memiliki muatan listrik sejenis. Apabila muatan listrik itu hilang , maka partikel koloid tersebut akan bergabung membentuk gumpalan. Proses penggumpalan partikel koloid dan pengendapannya disebut Koagulasi.
f. Koloid pelindung
Sistem koloid dimana partikel terdisperesinya mempunyai daya adsorpsi yang relatif besar disebut koloid liofil.
Sistem koloid dimana partikel terdisperesinya mempunyai daya adsorpsi yang relatif besar disebut koloid liofil.
Pembuatan Koloid
Ukuran partikel koloid
berada di antara partikel larutan dan suspensi, karena itu cara pembuatannya
dapat dilakukan dengan memperbesar partikel larutan atau memperkecil partikel
suspensi. Maka dari itu, ada dua metode dasar dalam pembuatan sistem koloid,
yaitu:
- Metode kondensasi yang
merupakan metode bergabungnya partikel-partikel kecil larutan sejati yang
membentuk partikel-partikel berukuran koloid
- Metode dispersi yang
merupakan metode dipecahnya partikel-partikel besar sehingga menjadi
partikel-partikel berukuran koloid.
Pemurnian
Koloid
Seringkali
terdapat zat-zat terlarut yang tidak diinginkan dalam suatu pembuatan suatu
sistem koloid. Partikel-partikel tersebut haruslah dihilangkan atau dimurnikan
guna menjaga kestabilan kolid. Ada beberapa metode pemurnian yang dapat
digunakan, yaitu:
a. Dialisis
Dialisis
adalah proses pemurnian partikel koloid dari muatan-muatan yang menempel pada
permukaannya. Pada proses dialisis ini digunakan selaput semipermeabel.
b. Elektrodialisis
Pada
dasarnya proses ini adalah proses dialysis di uh
medan listrik.
c. Penyaring Ultra
Partikel-partikel kolid tidak dapat
disaring biasa seperti kertas saring, karena pori-pori kertas saring terlalu
besar dibandingkan ukuran partikel-partikel tersebut. Tetapi, bila kertas
saring tersebut diresapi dengan selulosa seperti selofan, maka ukuran pori-pori
kertas akan sering berkurang. Kertas saring yang dimodifikasi tersebut disebut
penyaring ultra.
Alat
dan Bahan :
Cara Kerja :
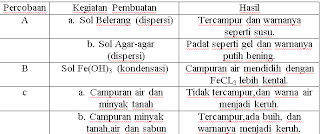
Percobaan A : Pembuatan
Sol dengan Cara Dispersi
a.
Sol belerang dalam air
1.
1 bagian gula
dengan 1 bagian belerang dicampurkan,lalu gerus dengan alu
dan lumpang sampai halus
2.
Diambil 1
bagian campuran diatas dan campurkan
kembali dengan 1 bagian gula, lalu gerus kembali sampai halus.
3.
Dan ulangi langkah nomor 2
sampai empat kali. Lalu, ambil 1 bagian campuran keempat dan tuangkan campuran itu
ke dalam gelas kimia yang berisi 50 ml air. Kemudian aduk campuran ini. Amati hasilnya.
b.
Sol agar-agar dalam air
1.
Ambil agar-agar sebanyak 2
spatula kaca dan larutkan ked lam gelas kimia yang berisi 25
ml air mendidih.
2.
Dinginkan campuran tersebut dan
perhatikan apa yang terjadi. Cara ini disebut peptisasi.
Percobaan B : Pembuatan
sol dengan cara kondensasi
1.
50 ml air
dalam gelas kimia 100
ml dipanaskan sampai mendidih.
2.
Lalu tambahkan larutan FeCl3 jenuh
setetes demi setetes sambil diaduk hingga larutan berubah warna menjadi merah
kecoklatan. Amati hasilnya.
Percobaan C :
Pembuatan emulsi
1.
1 ml minyak tanah dan
5 ml air dimasukan ke dalam suatu tabung reaksi, lalu disumbang
dengan tutup gabus atau karet. Guncangan tabung dengan keras. Letakan tabung
reaksi di rak.
2.
1 ml minyak tanah, 5
ml air dan 15 tetes sabun dimasukan ke
dalam tabung reaksi lain, lalu disumbang dengan tutup gabus atau karet.
Guncangan tabung dengan keras. Letakan tabung reaksi di rak. Amati kedua tabung
tersebut.
Hasil Pengamatan :
Pertanyaan :
1.
Jelaskan perbedaan pembuatan koloid
secara disperse dan kondensasi !
Jawab : Metode
kondensasi yang merupakan metode
bergabungnya partikel-partikel kecil
larutan sejati yang
membentuk partikel-partikel berukuran koloid.Metode
dispersi
yang merupakan metode dipecahnya partikel-partikel besar
sehingga
menjadi partikel-partikel berukuran koloid.
2.
Apa fungsi gula dalam pembuatan
belerang?
Jawab : Fungsi gula adalah
untuk memudahkan
menghaluskan/memecah butiran belerang menjadi partikel
partikel koloid.Setelah campuran dimasukan dalam air gula
akan larut sedangkan
belerang tidak larut menghasilkan sol
belerang.
3.
Apa yang terjadi pada saat larutan
FeCl3 jenuh diteteskan kedalam air mendidih? Tuliskan reksi
kimianya!
Jawab : Campuran air mendidih dengan FeCL3
lebih kental.
Kesimpulan :
Dari percobaan yang telah kami buat,
kami dapat
membedakan serta memahami pembuatan koloid secara
disperse dan kondensasi.
Anggota Kelompok : Adi, Afif, Alifaresa, Arkan, Diah

1 komentar:
pasang barnner gratis bung mumpung lagi promosi , ayo buruan kunjungi!! http://akangyanto.blogspot.com/
Posting Komentar